作者:生物谷
先前的研究表明,肥胖相关炎症会导致共病,而免疫调节在脂肪组织稳态中起重要作用。越来越多的证据表明,肥胖症患者的免疫系统严重失调,并导致轻度炎症状态。免疫细胞在脂肪组织的内环境稳定中起着重要作用,促炎细胞和抗炎细胞之间平衡失调会促进肥胖的进展。然而,非炎症性的稳态环境是如何转变为导致肥胖的炎症状态呢?这一系列过程的起始机制尚不清楚。
程序性死亡配体1(programmed death-ligand 1,PD-L1)是调节适应性免疫的关键分子之一,PD-L1已经被证明是T细胞极化的有效调节器。有研究发现巨噬细胞、树突状细胞和2型固有淋巴细胞(type 2 innate lymphoid cell,ILC2)表达了PD-L1,并调节表达PD-1的T细胞和ILC2。抗体介导的PD-L1抑制在抗肿瘤和自身免疫反应中释放TH1细胞的刹车。因此,我们假设PD-L1在维持脂肪组织内环境稳定中发挥重要作用,并在饮食诱导肥胖模型和肥胖患者样本中使用转基因小鼠研究了PD-L1在肥胖期间的细胞特异性功能。
近日,专业学术期刊《科学 转化医学》最新发表了一项肥胖症方面的研究,来自德国和爱尔兰的研究人员使用条件基因敲除的小鼠,研究了共刺激分子PD-L1在限制饮食诱导的肥胖中的作用。

研究人员发现,树突状细胞上的PD-L1可以控制脂肪组织内的适应性免疫反应,从而限制饮食诱导的肥胖。在高脂饮食的小鼠中,树突状细胞PD-L1缺乏,促进了肥胖增加以及脂肪组织T细胞极化受损。不过,抗PD-L1单抗治疗降低了高脂饮食小鼠的糖耐量。肥胖患者脂肪组织中PD-L1的表达也增加,这表明树突状细胞上的PD-L1也可能对抗人类的脂肪炎症。
在饮食诱导肥胖期间,使用条件基因敲除小鼠,对树突状细胞进行PD-L1功能性消融,可增加体重并产生代谢综合征,而在2型固有淋巴细胞、T细胞和巨噬细胞上的PD-L1表达对于肥胖控制并非必须。
通过体外共培养,树突状细胞通过PD-L1:PD-1轴与T细胞和ILC2相互作用,分别抑制辅助性T细胞1型增殖并促进2型极化。该研究还证明了PD-L1在人体脂肪组织调节中的作用,肥胖患者内脏脂肪中PD-L1的表达与体重增加呈正相关。因此,研究人员定义了由树突状细胞表达PD-L1控制的脂肪组织内稳态机制,这可能是免疫检查点抑制剂治疗期间免疫相关不良事件的临床相关发现。
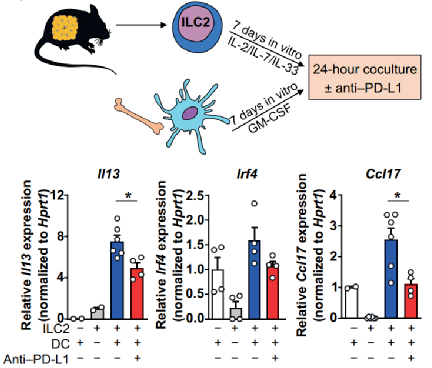
图注:在体外,树突状细胞通过PD-L1:PD-1的相互作用与CD4+T细胞和ILC2进行相互作用。
在小鼠模型中,树突状细胞上表达的PD-L1作为脂肪组织免疫的有效调节因子发挥了重要作用:首先,脂肪组织树突状细胞在小鼠和人类中表达大量的PD-L1;第二,结构性PD-L1和树突状细胞特异性PD-L1的缺乏会导致体重增加,损害代谢功能,并使T细胞极化向TH1转移;最后,PD-L1体外阻断会影响TH2极化和ILC2功能。结合次研究中体内的检查点抑制的结果,研究人员发现了它们对T细胞极化和体重减轻的直接影响,这些数据表明树突状细胞上的PD-L1维持了脂肪组织的稳态环境,并且可以对抗炎症。
综上,这项新研究的结果在先前发现的基础上,证实了抗PD-L1单抗治疗降低了高脂饮食小鼠的糖耐量,指出了树突状细胞上的PD-L1对抗人类脂肪炎症的潜在作用。
参考来源:
1. Schwartz C, Schmidt V, Deinzer A, Hawerkamp HC, Hams E, Bayerlein J, Röger O, Bailer M, Krautz C, El Gendy A, Elshafei M, Heneghan HM, Hogan AE, O'Shea D, Fallon PG. Innate PD-L1 limits T cell-mediated adipose tissue inflammation and ameliorates diet-induced obesity. Sci Transl Med. 2022 Mar 9;14(635):eabj6879.
doi: 10.1126/scitranslmed.abj6879. Epub 2022 Mar 9. PMID: 35263149.
撰文 | 拉缇莎
编辑|小耳朵
本文转载自其他网站,不代表健康界观点和立场。如有内容和图片的著作权异议,请及时联系我们(邮箱:guikequan@hmkx.cn)